Funktionsprinzip der Brennstoffzelle
Erstellt am: 23.03.2010 | Stand des Wissens: 01.12.2023
Synthesebericht gehört zu:
Ansprechpartner
IKEM - Institut für Klimaschutz, Energie und Mobilität e.V.
Das Funktionsprinzip der Brennstoffzelle wurde bereits im Jahre 1839 vom Engländer Sir William Robert Grove entdeckt, der an einer sogenannten Gasbatterie experimentierte. Seine Versuche basierten auf den Ergebnissen von Christian Friedrich Schönbein, der herausgefunden hatte, dass Elektrizität freigesetzt werden kann, wenn Wasserstoff mit Sauerstoff reagiert. Groove vermutete in diesem Zusammenhang richtigerweise die Umkehrung der Elektrolyse und gilt seitdem als Erfinder der Brennstoffzelle. Das Funktionsprinzip der Brennstoffzelle basiert grundsätzlich auf der direkten Umwandlung von chemischer Energie in elektrische Energie [Geit04a]. Die Brennstoffzelle als Energiewandler wandelt die im Wasserstoff gespeicherte Energie in Verbindung mit Sauerstoff in elektrische Energie und Wärmeenergie um. Als Abfallprodukt am Ort der Energieumwandlung entsteht lediglich Wasser. Mögliche Brennstoffe sind somit jeder wasserstoffhaltige Energieträger wie Methanol oder auch Erdgas [Kara03, S.24]. Die Brennstoffzelle ist somit lokal am Ort der Energieumwandlung völlig emissionsfrei.
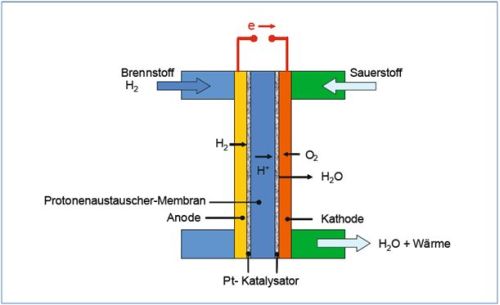 Abb. 1: Aufbau einer Brennstoffzelle [EiKl08, S.155]
Abb. 1: Aufbau einer Brennstoffzelle [EiKl08, S.155]Abbildung 1 zeigt die Reaktionen innerhalb einer Brennstoffzelle. Der Weg von der Anode zur Kathode ist durch eine Membran, die lediglich die Protonen leitet, unterbrochen. Diese Membran mit der dazugehörigen Katalysatorschicht wird als Membran Elektroden Einheit (MEA, englisch Membrane Electrode Assembly) zusammengefasst. Auf beiden Seiten wird die MEA zusätzlich noch von den Gasdiffusionsschichten (GDL, englisch Gas Diffusion Layer) umgeben, die für eine gleichmäßige Verteilung des Wasserstoffs sorgen, und von Bipolarplatten zusammengehalten, die die Zufuhr des Wasserstoffs und des Sauerstoffs ermöglichen [EiKl08, S.148]. Unterstützt durch den Katalysator der MEA, der vorwiegend aus Platin besteht, teilt sich der Wasserstoff in Protonen und Elektronen. Die Protonen wandern durch die Membran, die Elektronen müssen einen Umweg über den Elektronischen Verbraucher wählen und verbinden sich auf der anderen Seite der Membran mit den Protonen und Sauerstoff zu Wasser, wieder unterstützt von einem Katalysator. Neben der Elektrizität entsteht vor allem auch Wärme, die durch die Verluste bei der Reaktion entstehen [Pehn02, S.46f]. Um die Leistung einer Brennstoffzelle weiter zu erhöhen, werden viele Zellen hintereinander zu einem Stack (zu Deutsch: Stapel) geschaltet [Pehn02, S.47].
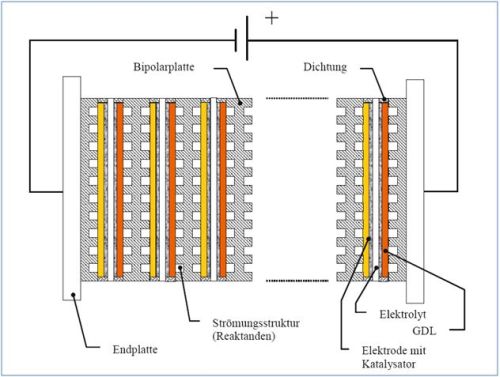 Abb. 2: Aufbau eines Brennstoffzellenstacks [EiKl08, S.155]
Abb. 2: Aufbau eines Brennstoffzellenstacks [EiKl08, S.155]Zusätzlich zum Brennstoffzellenstack, der lediglich für die Umwandlung der chemischen in elektrische Energie zuständig ist, werden weitere Komponenten für einen Brennstoffzellenantrieb benötigt [OeFl01, S.90]. Dazu gehören neben dem Elektromotor weitere Hilfskomponenten, wie der Verdichter, der Befeuchter und gegebenenfalls der Reformer. Für den laufenden Betrieb der Brennstoffzelle wird Wasserstoff benötigt, der entweder gasförmig oder verflüssigt an Bord des Fahrzeuges mitgeführt werden muss. Darüber hinaus gilt es, das entstehende Produktwasser und die Reaktionswärme kontrolliert abzuführen [Gerl02, S. 143].